The Telegraph rapporterede for nylig, at offentligheden er blevet bedt om at stoppe med at tage hoste- og forkølelsesmedicin på grund af sikkerhedsfrygter vedrørende stoffet pholcodin, et opioid hostedæmpende middel.
Tyve af de almindelige hoste- og forkølelsesmedicin, herunder dag- og natsygeplejerskekapsler, er blevet trukket tilbage fra markedet efter ordre fra lægemiddelmyndighederne på grund af bekymringer om en "meget sjælden" risiko for anafylaksi, en livstruende bivirkning.
'Class 2 Medicines Recall'-meddelelsen taget fra den britiske regerings hjemmeside, er vist nedenfor.

Når det kommer til mRNA COVID-19-vaccinerne, har de regulatoriske dobbeltstandarder aldrig været så åbenlyse.
Anafylaksi blev identificeret som en vigtig risiko af Det Europæiske Lægemiddelagentur allerede i december 2020 i EMA's CHMP (Committee for Medicinal Products for Human Use) vurderingsrapport om Pfizer-BioNTech COVID-19-vaccinen, som ses nedenfor.
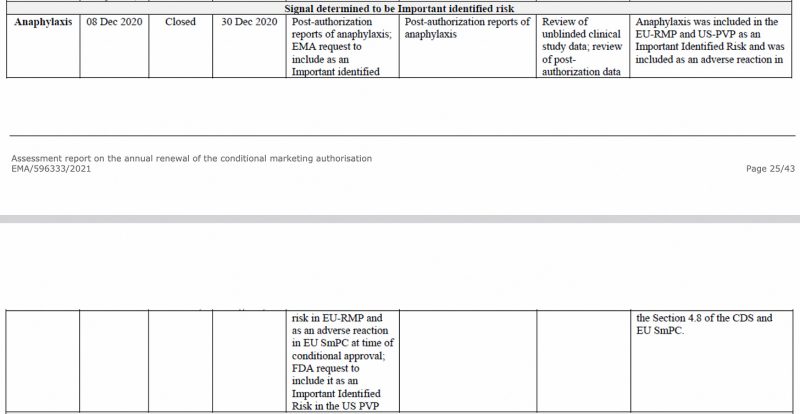
Også i EU's første periodiske sikkerhedsopdatering Rapport, som jeg har tidligere analyseret, blev anafylaksi igen markeret som en vigtig identificeret risiko.

I denne lægemiddelovervågningsrapport blev 3,827 relevante tilfælde (individer) identificeret ud fra data efter godkendelse. Landet med den højeste forekomst var Japan, efterfulgt af USA og Storbritannien.
Det højeste antal rapporterede tilfælde var blandt kvinder, chokerende 3,182 tilfælde sammenlignet med 454 tilfælde for mænd, med en medianalder på 44. Det faktum, at der blev rapporteret 7 gange flere tilfælde for kvinder, er ikke noget nyt. Tilbage i december 2021, I analyseret Pfizer forberedt dokumentet for FDA, der dækker 3-måneders perioden, december 2020 til 28. februar 2021 – i tilfælde af anafylaksi – var kvinder 8 gange mere ramt.
Så 98 procent af de relevante bivirkninger (inklusive anafylaktisk reaktion, anafylaktisk shock, anafylaktisk reaktion og anafylaktisk shock) blev klassificeret som alvorlige!
For 92 procent af hændelserne var den tid, der gik, før en uønsket hændelse opstod efter vaccineadministration, desuden mindre end 24 timer.

Fatale udfald
Af de 3,922 hændelser var 28 dødelige, og for svimlende 704 var resultatet ukendt. Der blev ikke givet nogen sagstal for dødelige udfald.

Sager efter aldersgruppe
Af de 3,827 relevante tilfælde (individer) var 23 fra den pædiatriske aldersgruppe og 3,021 fra den voksne aldersgruppe.
Tilstedeværelse af følgesygdomme
Hvad der er bemærkelsesværdigt er, at omkring 2/3 af alle anafylaksi tilfælde gjorde det ikke har nogen følgesygdomme (underliggende helbredsproblemer).

I betragtning af, hvad der er sket, siden mRNA COVID-19-vaccinerne blev rullet ud, kommer det ikke som nogen overraskelse at læse: "ingen nye sikkerhedsoplysninger blev identificeret vedrørende risikoen for anafylaksi med BNT162b2” (Pfizer-BioNTech COVID-19-vaccine). Begrundelsen (eller undskyldningen, de gemmer sig bag) er, at "denne risiko er kommunikeret.. som omfatter oplysninger om passende foranstaltninger, der skal træffes, som følger: "Som med alle injicerbare vacciner skal passende medicinsk behandling og overvågning altid være let tilgængelig. i tilfælde af en sjælden anafylaktisk hændelse efter administration af vaccinen."
Under Forordning 174, Information til sundhedspersonale i Storbritannien, som sidst blev revideret i december 2021, står følgende:

n faktisk på selve første dag af udrulningen af Pfizer-BioNTech COVID-19-vaccinen i Storbritannien, var der to rapporter om anafylaksi og et rapporteret tilfælde af en mulig allergisk reaktion. Dette forhindrede ikke MHRA i at tilbagekalde produktet - de omgik simpelthen problemet ved at sige, at folk, der har en historie med allergi, ikke bør tage vaccinen.
Selv når de vidste- Pfizer/BioNTechs lipid nanopartikelingredienser ALC-0159 og ALC-0315 har aldrig været inkluderet i noget licenseret lægemiddel før. ALC-0159 indeholder PEG (Polyethylenglycol), som er kendt for at forårsage anafylaksi.
Det er utvetydigt: anafylaksi var en kendt livstruende uønsket hændelse, omkring samme tidspunkt blev der givet nødbrugstilladelse til Pfizer-BioNTech COVID-19-vaccinen. Men fordi det er en "injicerbar vaccine", har den på en eller anden måde fået fri adgang fra alle lægemiddelregulatorer, uanset hvor mange forbandende data der akkumuleres, når en hostesirup eller kapsel på den anden side hurtigt bliver tilbagekaldt på grundlag af en "en meget sjælden risiko for anafylaksi."
Genudgivet fra forfatterens understak
Udgivet under a Creative Commons Attribution 4.0 International licens
For genoptryk, sæt venligst det kanoniske link tilbage til originalen Brownstone Institute Artikel og forfatter.









