I denne uge har den amerikanske fødevare- og lægemiddeladministration (FDA) autoriseret brugen af en enkelt booster af Pfizers covid-19-vaccine til børn i alderen 5-11, mindst fem måneder efter afslutningen af en primær serie af vaccinationer. CDC's rådgivende udvalg forventes at gummistemple beslutningen i dag.
Ifølge FDA kom beviserne bag dens beslutning fra en undergruppe af 67 børn, som var en del af et igangværende forsøg og blev boostet 7-9 måneder efter deres primære serie. De viste højere antistofniveauer en måned efter boosteren sammenlignet med før boosteren.
FDA's beslutning er dristig af flere grunde.
Mangel på data
Netop når FDA burde kræve bedre data, sænker agenturet sine standarder.
Ingen strenge undersøgelser i denne aldersgruppe har vist, at en tredje dosis kan reducere vigtige resultater såsom hospitalsindlæggelser og dødsfald – de randomiserede kliniske forsøg er ikke blevet udført, på trods af at Pfizer tjener milliarder i omsætning.
I stedet var beslutningen baseret på tilstedeværelsen af "neutraliserende antistoffer", fordi de er nemme at måle og studere. Ikke alene falmer antistofniveauer hurtigt, men de korrelerer heller ikke nødvendigvis med beskyttelse.
FDA's egen hjemmeside siger, at "antistoftest ikke bør bruges til at evaluere en persons niveau af immunitet eller beskyttelse mod covid-19." Og alligevel er det, hvad agenturet har gjort.
Dette følger tidligere data fra New York under omicron-stigningen, der viste, at Pfizers vaccineeffektivitet hos 5-11-årige faldt fra 68 % i midten af december 2021, ned til kun 12 % i januar 2022, et godt stykke under FDA's oprindelige tærskel på 50 %.
Lægemiddelmyndighedernes og sundhedsmyndighedernes nærsynede fokus på antistoffer har været på bekostning af at overveje andre vigtige aspekter af immunsystemet, såsom CD4+ T-celler og naturlige dræberresponser, som spiller en afgørende rolle i at forebygge infektion og menes at være mere holdbare end antistoffer. Desværre er disse data stort set blevet ignoreret af myndighederne.
Dr. Peter Marks, direktør for FDA's Center for Biologisk Evaluering og Forskning, anerkendte, at viser data i stigende grad at beskyttelsen efter to doser aftager over tid, og at et tredje skud kan hjælpe med at øge beskyttelsen for børn i aldersgruppen 5 til 11, fordi "fordelene opvejer risiciene."
Men med hensyn til sikkerhed har FDA kun vurderet cirka 400 børn, der fik en boosterdosis, og eventuelle alvorlige, sjældne skader ville ikke blive opdaget i så lille en stikprøvestørrelse.
Ignorerer naturlig immunitet
Ved at godkende en tredje dosis til alle 5-11-årige – hvoraf de fleste allerede har naturlig immunitet – vil det næppe give yderligere fordele og kan udsætte dem for unødvendig skade.
Den amerikanske CDC rapporteret at omkring 75 % af børn og unge har serologiske beviser (antistoffer) fra en tidligere infektion og derfor allerede har udviklet robust og holdbar beskyttelse mod covid-19.
Den britiske regering anslået at over 85 % af børn i alderen 5-11 år havde fået covid-19 i januar 2022, og at deres erhvervede naturlige immunitet ville give beskyttelse mod alvorlig sygdom eller fremtidig geninfektion.
Marty Makary, professor ved Johns Hopkins School of Medicine skrev i The Wall Street Journal, at naturlig immunitet sandsynligvis vil være meget robust hos børn i betragtning af deres stærkere immunsystem. Han sagde, at hvis et barn allerede havde haft covid-19, "ville der ikke være noget videnskabeligt grundlag for vaccination."
Han observerede også, at der ikke blev dokumenteret nogen tilfælde af covid-19 i hverken den vaccinerede gruppe eller placebogruppen hos børn, der tidligere var blevet inficeret med SARS-CoV-2 under Pfizers forsøg, hvilket forstærkede fordelen ved naturlig immunitet.
Rådgivende panel
Vaccines and Related Biological Products Advisory Committee (VRBPAC) giver ikke kun indsigt og ekspertise til agenturet, men det giver troværdighed og troværdighed til FDA's beslutningsproces.
FDA indkaldte dog ikke sit rådgivende panel i denne uge og sagde, at det allerede havde diskuteret boostere på et tidligere møde, og at yderligere diskussion ikke ville være til nogen fordel.
Nogle medlemmer har udtrykt bekymring for, at lægemiddelregulatoren gentagne gange er gået videre med beslutninger om boosterdoser uden at holde åbne offentlige diskussioner og siger, at agenturet stoler mindre og mindre på sine uafhængige eksperter for rådgivning, før de godkender lægemidler.
I en seneste analyse, viste forskere, at kun 6 % af lægemidler godkendt af FDA blev gennemgået af rådgivende paneler i 2021, ned fra 55 % i 2010 (se figur).
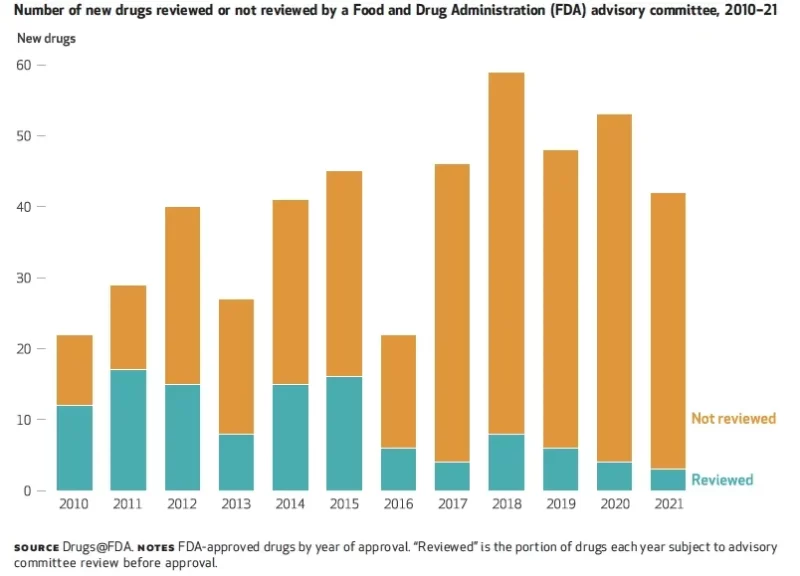
Hvis offentlighedens tillid afspejler disse tal, har reguleringsorganer en lang vej at gå med at genvinde tilliden til deres beslutningsprocesser.
Optagelse?
På trods af den fortsatte udvidelse af boostere, synes begejstringen for vaccinerne at være aftagende. Covid-19-vaccinerne er ikke så effektive til at forhindre infektion og overførsel, som oprindeligt håbet, og med så lille en risiko for alvorlig sygdom hos børn, bliver forældrene mindre overbeviste.
A nylig amerikansk undersøgelse fandt, at næsten en tredjedel af forældre til børn under 5 år sagde, at de "bestemt ikke" ville få deres barn vaccineret i første omgang, yderligere 11% sagde, at de kun ville gøre det, hvis det var påkrævet (mandat), og 38% planlagde at vente i orden for at se, hvordan vaccinen virkede for andre.
Pfizer har endnu ikke indsendt sin ansøgning til FDA om en tre-dosis vaccine til børn under 5 år, men det forventes at gøre det i de kommende uger.
Oprindeligt opslået på forfatterens websted
Udgivet under a Creative Commons Attribution 4.0 International licens
For genoptryk, sæt venligst det kanoniske link tilbage til originalen Brownstone Institute Artikel og forfatter.









